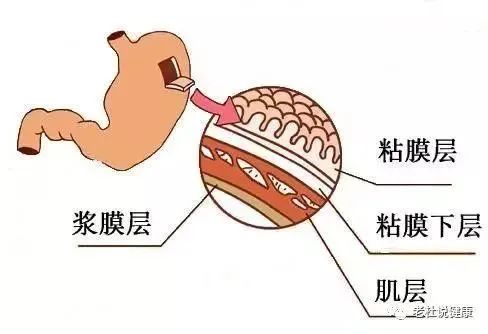
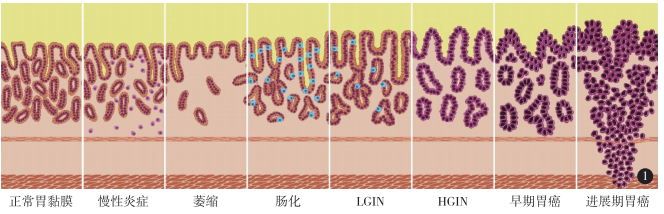
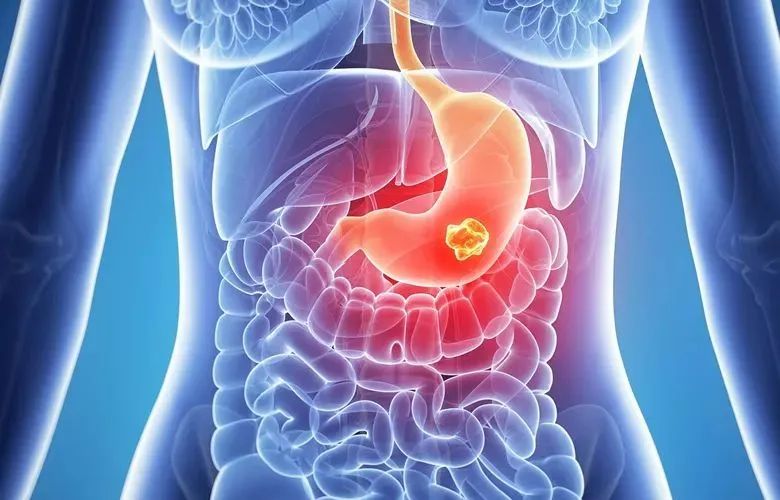
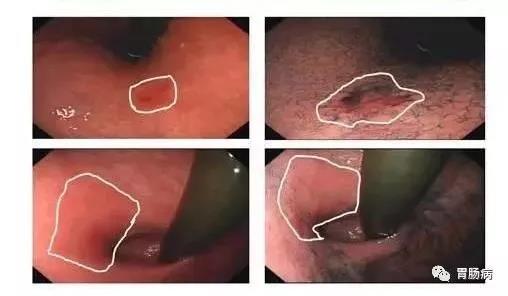
胃癌是指原发于胃的上皮源性恶性肿瘤。全球每年新发胃癌病例约 120 万,中国约占其中的 40%。在我国胃癌发病率仅次于肺癌居第二位,死亡率排第三位。 我国早期胃癌占比很低,仅约 20%,大多数发现时已是进展期,总体 5 年生存率不足 50%。
近年来随着胃镜检查的普及,早期胃癌比例逐年增高。所有的肿瘤都会在不同程度上影响营养素的摄入和/或利用,从而造成营养不良。
不同肿瘤营养不良的发生率不同,大体上说消化系统肿瘤高于非消化系统肿瘤,上消化道肿瘤高于下消化道肿瘤。
胃癌患者营养不良的原因主要有:
疾病本身导致的厌食、抑郁相关性厌食使食物摄入减少。在所有肿瘤中,胃癌引起的厌食、早饱感发生率最高;
机械性因素造成的摄入困难;
化疗药物毒性引起的吸收和消化障碍;
合并有分解代谢增加的因素,比如感染或手术治疗。同期放化疗具有吸烟饮酒嗜好的胃癌患者,在粒细胞下降时容易发生局部感染;
胃手术特有的影响:在所有胃肠道手术中,以胃手术的并发症最多、对营养与代谢的影响最大、持续时间最长。
临床上,营养不良是胃癌患者的常见问题。15%的患者在诊断初期即有体重减轻。
胃癌病人发生营养不良的原因及机制复杂,与肿瘤本身的特点及抗肿瘤治疗对机体的影响有关。恶性肿瘤导致进食调节中枢功能障碍,手术、放化疗等抗肿瘤治疗导致的疼痛、恶心呕吐、焦虑抑郁等,引起厌食和早饱,影响营养物质的摄入。同时,肿瘤病人的营养物质代谢特点不同于非肿瘤病人,碳水化合物代谢异常、蛋白质转化率增加、脂肪分解增加、脂肪储存减少、肌肉及内脏蛋白消耗、瘦体重减少、水电解质平衡紊乱、能量消耗改变等,均会诱发和加重营养不良。
与所有营养不良一样,胃癌相关性营养不良带来的负面影响也体现在机体及功能两个层面。它削弱了放化疗的疗效,增加了药物不良反应风险、术后并发症和院内感染的机会以及各种并发症的发生率和病死率,降低了骨骼肌质量和功能以及患者的生活质量,延长了住院时间,增加了医疗费用。营养不良还限制了胃癌患者治疗方案的选择,使得他们不得不选择一些非最优或者不恰当的治疗方案。总之,营养不良与预后不良密切相关。对于接受肿瘤手术切除的胃癌患者和接受姑息治疗的胃癌患者来说,充足的营养支持是必不可少的。营养不良的胃癌患者面临着更大的风险,包括更高的并发症发生率和更低的生存率。因此,营养不良在胃癌的治疗中显得尤为重要。
胃癌也是一种代谢相关性疾病,其营养代谢特点包括:
1.能量代谢异常
一些调查报道显示癌症病人能量代谢需要比正常代谢高10%。但亦有报道认为未见有明显差别。然而癌症病人的体重下降较明显,除摄入减少的原因外,消耗的增加亦是不能忽视的一个方面。
2. 碳水化合物代谢异常
有氧糖酵解增强,葡萄糖摄取和消耗增加,主要表现为葡萄糖的氧化和利用降低,葡萄糖转化增加,胰岛素抵抗和胰岛素分泌相对不足。
3. 脂肪代谢异常
癌症病人有大量蛋白质的丧失,应激和肿瘤本身释放脂溶因素可使脂肪分解作用增加,合成降低,血清脂蛋白脂酶活性降低,出现高脂血症,主要表现为血浆脂蛋白、甘油三酯和胆固醇升高,外源性脂肪利用下降,脂肪动员增加。
4. 蛋白质代谢异常
癌症病人体内蛋白质的转换率增加。肝脏蛋白质合成增加,肌肉中的蛋白质合成降低。主要表现为骨骼肌不断降解,体重下降,内脏蛋白消耗和低蛋白血症,血浆支链氨基酸含量下降。
5. 维生素代谢异常
病人血浆中可见到抗氧化营养素下降,如 β-胡萝卜素,维生素 C、E 等。此外,其他维生素如维生素 B12 在胃癌病人血浆中含量降低,叶酸亦有降低。
6. 微量元素代谢异常
癌症病人大多都有血硒含量的降低和锌含量的降低,同时可见到抗氧化能力降低和细胞免疫功能的下降。胃癌病人还可见到血钴和血锰含量的下降。
胃癌病人的营养治疗是综合治疗的重要组成部分,应从疾病确诊开始,在多学科综合治疗协作组(MDT)讨论时参与治疗方案的制定和调整,贯穿抗肿瘤治疗的全过程。
胃癌综合治疗方案的制定和优化依赖多学科协作,除手术、放化疗、靶向治疗等抗肿瘤治疗手段之外,营养治疗也是胃癌综合治疗的重要组成部分,是一线治疗。
营养不良会严重影响病人对治疗的耐受性和疗效,增加不良反应和治疗并发症,影响抗肿瘤治疗方案的顺利实施。通过营养治疗,包括饮食指导、 改善摄食、经口营养补充和人工营养支持,为机体提供充足的营养底物,防止营养状况的进一步恶化,帮助病人更加安全地接受抗肿瘤治疗。
1. 能量和蛋白质需求
胃癌病人能量摄入应尽量接近实际消耗,保持能量平衡,避免能量不足或喂养过度。若条件允许,推荐采用间接测热法对病人静息能量消耗进行测定。若无法测定病人的能量消耗值,也可采用体重公式进行估算,按照 25~30 kcal/(kg·d)来计算能量的目标需要量,但需要根据病人的年龄、活动量、应激水平、肝肾功能等情况进行校正和调整,理想的实际补充量应达到目标需要量的 80%左右。
对于长期营养不良的病人,营养治疗应循序渐进,监测电解质及血糖水平,警惕再喂养综合征的发生。病人术后早期受手术创伤、炎症等刺激,处于应激状态,允许相对低热量供能[15~25 kcal/(kg·d)],利于降低感染相关并发症的发生率。
充足的蛋白质供应对胃癌患者十分重要,充足的能量和蛋白质摄入可明显降低危重病人的死亡风险。ESPEN 推荐对恶性肿瘤病人按照 1.0~2.0g/(kg·d)补充蛋白质。胃癌手术病人围手术期推荐按照 1.2~1.5g/(kg·d)计算蛋白质需要量。接受大型手术的病人或处于重度应激反应的病人对蛋白质的需求量更高,围手术期按照 1.5~2.0g/ (kg·d)补充蛋白质,并根据病人实际情况适当调整。
非荷瘤状态下三大营养素的供能比例与健康人相同,为 :碳水化合物50%~55%、 脂肪 25%~30%、蛋白质 15% ;荷瘤患者应该减少碳水化合物在总能量中的供能比例,提高蛋白质、脂肪的供能比例。按照需要量 100% 补充矿物质及维生素,根据实际情况可调整其中部分微量营养素的用量。
2. 营养不良的五阶梯治疗模式
营养不良的规范治疗应该遵循五阶梯治疗原则:首先选择营养教育,然后依次向上晋级选择口服营养补充(ONS)、全肠内营养(TEN)、 部 分 肠 外 营 养(PPN)、全肠外营 养(TPN)。参照 ESPEN 指南建议,当下一阶梯不能满足 60% 目标能量需求 3~5 天时,应该选择上一阶梯。

胃癌患者营养治疗的途径同样包括肠内营养(口服、管饲)及肠外营养(静脉)。口服是生理的途径,是第一选择。胃癌患者围手术期、围放疗期、围化疗期等治疗期间乃至家居期间营养治疗首选口服营养补充(ONS), 必要时辅以静脉途径补充口服 (日常饮食 +ONS)摄入的不足部分,如部分肠外营养(PPN)或补充性肠外营养(SPN)。
任何情况下,只要肠内途径可用,应优先使用肠内营养。手术后应尽早(24 小 时内)开始肠内营养。术后患者推荐首选肠内营养;鼓励患者尽早恢复经口进食,对于能经口进食的患者推荐口服营养支持;对不能早期进行口服营养支持的患者,应用管饲喂养,胃癌患者推荐使用鼻空肠管行肠内营养。
补充性肠外营养(SPN)给予时机:NRS-2002≤3 分或 NUTRIC Score≤5 分的低营养风险患者,如果 EN 未能达到 60%目标能量及蛋白质需要量超过 7 天时,启动 SPN 支持治疗;NRS-2002≥5 分或 NUTRIC Score≥6 分的高营养风险患者,如果 EN 在 48~72 小时内无法达到 60%目标能量及蛋白质需要量时,推荐早期实施 SPN。当肠内营养的供给量达到目标需要量 60%时,停止SPN。
营养干预的疗效评价指标分为三类 :
1. 快速变化指标:为实验室参数,如血常规、电解质、肝功能、肾功能、炎症参数(IL-1、IL-6、TNF、CRP)、营养套餐(白蛋白、前白蛋白、转铁蛋白、视黄醇结合蛋白、游离脂肪酸)、血乳酸等,每周检测 1~2 次。
2. 中速变化指标:人体测量参数、人体成分分析、生活质量评估、体能评估、肿瘤病灶评估(双径法)、PET-CT 代谢活性。每 4~12 周评估一次。
3. 慢速变化指标:生存时间,每年评估一次。
来源:中国营养学会肿瘤营养管理分会《中国肿瘤患者膳食营养白皮书2020-2021》,由医世象整编。